 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 68 篇 doi: 10.5376/mpb.cn.2011.09.0068
收稿日期: 2011年04月22日 接受日期: 2011年05月20日 发表日期: 2011年06月01日
孙翊等, 2011, 瓜叶菊F3H同源基因表达与花青素苷合成的相关性分析, 分子植物育种 Vol.9 No.68 (doi: 10.5376/mpb.cn.2011.09.0068)
为了探讨瓜叶菊黄烷酮3-羟基化酶(flavanone 3-hydroxylase, F3H)在类黄酮生物合成途径中的作用,本文作者以瓜叶菊(Pericallis cruenta L′Herit; Senecio cruentus Masson ex L′Herit)不同色系品种作为实验材料,分析基因表达与色素成分之间的关系。类黄酮成分的紫外-可见吸收光谱分析表明,红色系、紫色系、蓝色系舌状花中既含有花青素又含有花黄素,而白色系舌状花中仅含有花黄素。Southern blot检测发现,F3H同源基因在不含有花青素苷的白色和含有花青素苷的蓝色瓜叶菊基因组上均至少分布有2个拷贝。Northern blot分析结果显示,两种颜色的瓜叶菊舌状花中均具有F3H同源基因的转录本,且表达水平均相同,与是否含有花青素苷并不直接相关。上述研究结果表明:瓜叶菊中F3H同源基因可能不仅参与了花青素苷的合成,还参与了花黄素的合成。根据这一研究结果还可以推测出,白色系与其他色系瓜叶菊之间的花色差异是在F3H基因之后的合成步骤中产生的,因此瓜叶菊白色系品种可以作为研究花青素苷合成途径中F3H基因下游其他基因功能的良好受体材料。
类黄酮(flavonoid)是植物花色素的主要类群之一,它主要包括花青素苷(anthocyanin)和花黄素(anthoxanthin)两大类 (Tanaka et al., 2008)。其中,花青素苷是花器官呈现橙、粉红、红、蓝、紫等一系列颜色的最主要原因(Tanaka and Ohmiya, 2008),包括黄酮(flavone)和黄酮醇(flavonol)在内的花黄素呈现淡黄色或近于无色(Tanaka et al., 2008)。
黄烷酮3-羟基化酶(flavanone 3-hydroxylase, F3H, EC 1.14.11.9)能够使得黄烷酮(flavanone, 又称二氢黄酮)的C3位发生羟基化,其催化形成的二氢黄酮醇(dihydroflavonol)是进一步合成黄酮醇和花青素苷的必要前体物质(Britsch and Grisebach, 1986; Clegg and Durbin, 2000)。因此,其催化的步骤是花青素苷合成途径与其它类黄酮物质分支途径的主要交叉点之一(Pelt et al., 2003; 侯夫云等, 2009; 吴少华和张大生, 2002)。1991年,Martin利用差异筛选和基因图谱结合的方法从金鱼草(Antirrhinum majus)中首次分离出了F3H基因(Martin et al., 1991);随后,Britsch等采用酶纯化法从矮牵牛(Petunia hybrida)中分离出了F3H的同源基因(Britsch et al., 1992);此后,在许多物种中分离得到F3H同源基因,如苹果(Malus pumila) (Davies, 1993)、葡萄(Vitis vinifera) (Sparvoli et al., 1994)、银杏(Ginkgo biloba) (Shen et al., 2006)、蒺藜苜蓿(Medicago truncatula) (Shen et al., 2010)、山茶(Camellia japonica) (Tateishi et al., 2010)等。已有研究表明,F3H在不同物种基因组中的存在形式不同,有的只存在单一拷贝,如紫花苜蓿(Medicago sativa) (Charrier et al., 1995)、玉米(Zea mays) (Deboo et al., 1995)和拟南芥(Arabidopsis thalian) (Pelletier and Shirley, 1996);有的以多基因家族形式存在,如紫苏(Perilla frutescens) (Gong et al., 1997)、圆叶牵牛(Ipomoea purpurea) (Clegg and Durbin, 2000)和银杏(Shen et al., 2006)。在矮牵牛和金鱼草中,f3h位点的突变可以使F3H失去活性,从而产生白色的花(Schijlen et al., 2004)。向香石竹(Dianthus caryophyllus)中反义导入F3H基因,使花色发生了不同程度的改变,转基因株系部分或完全失去了原有的橙色或红色(Zuker et al., 2002)。瓜叶菊(Pericallis cruenta L′Herit; Senecio cruentus Masson ex L′Herit)是一种广为栽培且花色变异丰富的菊科植物,其花色包括白色、红色、紫色和蓝色等(胡可等, 2009)。目前,已经分离获得了瓜叶菊F3H同源基因的中间片段和3'末端序列(GenBank登录号: DQ471436),片段所编码的氨基酸序列与其它物种的相似性均较高,并含有其它物种中高度保守位点(胡可等, 2009)。然而,瓜叶菊F3H同源基因在基因组上分布的情况尚不清楚,该基因的表达与瓜叶菊舌状花中色素成分之间的关系之间关系也并不明确。本试验在对不同花色瓜叶菊舌状花类黄酮成分分析的基础上,研究了瓜叶菊F3H同源基因在基因组中分布的情况和该基因表达特性与花色形成之间的关系,以期为瓜叶菊F3H同源基因的功能研究以及深入探讨瓜叶菊花色形成的分子机理奠定基础,并为花色分子育种工作提供参考资料。
1结果和分析
1.1瓜叶菊舌状花中类黄酮的紫外-可见吸收光谱特征分析
采用紫外-可见光分光光度计测得白、红、紫、蓝4个色系瓜叶菊舌状花类黄酮提取液的紫外-可见吸收光谱值(表1)并绘制出紫外-可见吸收光谱图(图1)。从图1中可以看出,4个色系类样本的黄酮提取液在紫外光区吸收光谱的主要吸收峰位置十分相似,均集中在328 nm附近,此为花黄素的紫外吸收特性。4个色系类黄酮提取液在可见光区吸收光谱有一定的差异(图2)。白色系在可见光区没有明显吸收峰,而红色系、紫色系和蓝色系在539~544 nm有较明显的花青素苷特征吸收峰。由光谱特征推断,在白色系瓜叶菊舌状花中仅含有花黄素,而不含有花青素苷。而红色系、紫色系、蓝色系瓜叶菊中的类黄酮为花黄素和花青素苷两种成分。此外,还发现红色系、紫色系和蓝色系的花青素苷特征吸收峰随着蓝色的增加,向红外光区偏移(表1)。
 图1 瓜叶菊舌状花瓣提取液紫外-可见光吸收谱 Figure 1 UV-Visible absorption spectras of flavonoids of ligulate flowers of cineraria |
 图2 瓜叶菊舌状花瓣提取液可见光吸收谱 Figure 2 Visible absorption spectras of flavonoids of ligulate flowers of cineraria |
表1 瓜叶菊舌状花类黄酮特征吸收峰 Table 1 The absorption peaks of flavonoids of ligulate flowers of cineraria |
1.2瓜叶菊基因组中F3H同源基因拷贝数的检测
为了检测F3H同源基因在瓜叶菊基因组中的分布情况,选择白色系作为仅含有花黄素的代表材料,蓝色系作为既含有花黄素又含有花青素苷的代表材料。根据已知的瓜叶菊F3H同源基因序列设计的特异性探针,对白色系和蓝色系基因组DNA进行的Southern blot分析,结果检测到了2或3个条带(图3)。这一结果说明,在无论是否含有花青素苷的瓜叶菊基因组中F3H同源基因的分布情况相同,为至少含有2个拷贝。
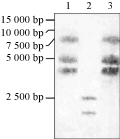 图3 瓜叶菊基因组中F3H同源基因Southern blot分析 Figure 3 Southern blot analysis of F3H homologous gene in cineraria genome |
1.3瓜叶菊F3H同源基因的表达特性分析
对蓝色系瓜叶菊不同发育阶段的舌状花进行Northern blot分析发现,该基因在舌状花发育初期高峰度表达,随着花序的发育,其表达丰度逐渐降低(图4A);在管状花发育初期也含有瓜叶菊F3H同源基因的转录本(图4A),这表明其并非舌状花特异性表达基因;同样选择白色系作为仅含有花黄素的代表材料,蓝色系作为既含有花黄素又含有花青素苷的代表材料进行表达分析。Northern blot检测的结果发现,在这两种不同色系的舌状花中均能够检测到该基因的转录本,且表达强度无显著差异(图4B)。即,无论是否含有花青素苷,在白色系和蓝色系瓜叶菊的舌状花中,F3H同源基因在表达水平上是相同的。
 图4 瓜叶菊F3H同源基因Northern blot分析 Figure 4 Northern blot analysis of F3H homologous gene in cineraria |
2结论和讨论
2.1瓜叶菊中F3H同源基因在花青素苷合成途径中的作用
本文以瓜叶菊不同色系品种作为实验材料,分析基因表达与色素成分之间的关系。类黄酮成分的紫外-可见吸收光谱分析表明,红色系、紫色系、蓝色系舌状花中既含有花青素又含有花黄素,而白色系舌状花中仅含有花黄素。Southern blot分析结果表明,瓜叶菊F3H同源基因在仅含有花黄素的白色系和还含有花青素的蓝色系瓜叶菊基因组上均至少分布有2个拷贝。Northern blot分析结果显示,两种颜色的瓜叶菊舌状花中均具有F3H同源基因的转录本,且表达水平均相同,与是否含有花青素苷并不直接相关。上述研究结果表明:瓜叶菊中F3H同源基因不仅参与了花青素苷的合成过程,而且还参与花黄素的合成过程。
2.2瓜叶菊类黄酮成分及其检测方法
本研究利用紫外-可见吸收光谱分析技术对瓜叶菊舌状花中类黄酮成分分析的结果表明,在白色系仅含有花黄素,并不含有花青素苷。已有研究认为,花青素苷元(anthocyanidin)主要种类天竺葵素(pelargonidin)、矢车菊素(cyanidin)和飞燕草素(delphinidin)在 0.01%盐酸-甲醇溶液中的可见光吸收峰分别为520 nm、535 nm和546 nm,即随着花青素分子B环上羟基基团数目递增,这些色素的可见光吸收峰值逐渐向红外光区偏移(Tanaka et al., 1998)。本研究同样发现,红色系、紫色系和蓝色系的花青素苷特征吸收峰依次向红外光区偏移。据此结果推测,在瓜叶菊花色从红到蓝的变化过程中,随着蓝色的不断增加,飞燕草素含量所占比重不断增加,花青素苷成分是影响瓜叶菊舌状花着色的主要因素。这与孙卫等(2009)利用高效液相色谱-光电二极管阵列检测技术(high-performance liquid chromatography with a photodiode array detector, HPLC-PAD/DAD)的研究结果是一致的。因此,对于已知化合物种类的物种进行色素成分分析时,使用紫外-可见吸收光谱法同样可以快速并有效地分析出类黄酮化合物的类群,对于研究类黄酮成分分析和基因表达关系的研究而言,它是一种是简便易行的方法。
2.3 F3H同源基因表达与瓜叶菊花青素苷合成的关系
对瓜叶菊F3H同源基因的表达分析发现,其在瓜叶菊舌状花和管状花中均具有表达,说明该基因并非舌状花特异性表达基因。研究还发现,该基因在舌状花发育初期高峰度表达,随后表达丰度逐渐降低。这一结果与胡可等(2009)采用RT-PCR的分析结果略有差异。认为技术方法的不同是产生该差异的主要原因。由于RT-PCR方法的局限性,认为Northern blot检测结果的更为准确。对比孙卫等(2010)对蓝色系花发育中总花青素苷含量变化趋势的研究结果发现,F3H同源基因的表达时期显著早于花青素苷的合成。据此推测,在蓝色花发育初期由于该基因的高丰度表达合成的大量F3H,并催化合成了二氢黄酮醇,经过下游酶的催化,在发育中期积累了最大含量的花青素苷。据此结果可以推测,F3H同源基因的表达是瓜叶菊花青素苷合成的必要条件。
研究中还发现,F3H同源基因在含有花黄素白色系和蓝色系中的表达情况相同。据此推断在它们的舌状花中均有二氢黄酮醇的合成。已有研究发现,在紫苏(Perilla frutescens)中,F3H同源基因仅在红色表现型植株叶片中表达,而不在绿色表现型植株叶片中表达。在小麦(Triticum aestivum)胚芽鞘中该基因的转录与花青素的合成也密切相关(Himi et al., 2005),在紫花苜蓿(Medicago sativa)中仅具有的单一拷贝的该基因仅在花器官中表达(Charrier et al., 1995),在玉米(Zea mays) 花药中仅有单一拷贝的该基因的转录与黄酮醇积累密切相关(Deboo et al., 1995)。因此认为,尽管F3H酶催化合成的二氢黄酮醇可以作为花青素苷和黄酮醇合成所需的共同底物(Britsch and Grisebach, 1986),但是在不同物种、不同花色表现的品种和不同颜色的组织中的该蛋白起到的作用可能并不完全相同。所以推断在瓜叶菊中,蓝色系舌状花中的二氢黄酮醇进一步合成有色的花青素苷,而白色系舌状花中的二氢黄酮醇进一步合成无色的黄酮醇类化合物,两者在类黄酮合成途径的晚期发生了分歧。蓝色系瓜叶菊F3H 的作用可能是多方面的,即既是催化花青素苷合成的关键酶,又是催化合成花黄素的关键酶。而在白色系F3H的作用可能仅限于催化合成花黄素。
2.4瓜叶菊白色系品种在花色研究中的应用前景
白色花形成的机理比较多样,类黄酮代谢途径中任意中上游基因的缺失都有可能导致白色花的形成(韩科厅等, 2008)。本研究通过类黄酮成分的分析以及F3H同源基因分子生物学分析,说明在白色瓜叶菊舌状花的类黄酮代谢途径早期能够生成二氢黄酮醇,与其它颜色中含有类黄酮物质的差异是由于F3H基因之后的晚期反应步骤趋向的差异造成的。分子育种工作的突出优势正在于其定向性(李静和车代弟, 2004)。因此,通过转单一基因或少数基因来改良花色的育种工作中,要获得花色有效改变的植株,必需要以对受体材料原有花色遗传调控途径的分析为基础(韩科厅等, 2008)。根据本研究结果推断,白色系瓜叶菊舌状花中能够合成二氢黄酮醇,为二氢黄酮醇还原酶(李静和车代弟, 2004)、黄酮醇3'-羟基化酶(白新祥和戴思兰, 2005)、黄酮醇3',5'-羟基化酶等下游基因提供底物(孟丽和戴思兰, 2004),因此它可以作为研究F3H基因下游基因功能的良好受体材料。
2.5 F3H同源基因不同拷贝的研究
本研究中Southern blot检测结果说明,F3H同源基因在在白色系和蓝色系瓜叶菊基因组上均分布有至少2个拷贝。据此推断,该基因在瓜叶菊基因组中是以多拷贝形式存在的。迄今为止,已知的F3H同源基因在大多数物种中仅以单拷贝形式存在(侯夫云等, 2009; 吴少华和张大生, 2002),然而本研究证明F3H同源基因在瓜叶菊基因组上至少有2个拷贝,这与圆叶牵牛中至少含有2个拷贝(Clegg and Durbin, 2000)以及银杏中F3H同源基因则被证明是以多基因家族形式存在的结果类似(Shen et al., 2006)。说明不同植物中F3H同源基因在基因组水平上存在着一定的差异。推测这不仅与不同植物花朵或果实中类黄酮种类的多样性有关,而且很可能与类黄酮具有的其它生理功能有关,比如抗氧化、光保护和抗虫等机制(Hodges and Derieg, 2009)。基因的拷贝数是花色形成调控的重要机制之一,基因家族中不同成员间功能也有差异(Koes et al., 1989)。因此进一步研究瓜叶菊中F3H同源基因不同成员的功能,对于揭示其花色形成机理以及类黄酮的生理生化功能具有重要的意义。
3材料和方法
3.1植物材料
瓜叶菊品种“春潮”购自中国北京市莱太花卉市场。采用目视测色法和Royal Horticultural Society Colour Chart比色法测定并获得白、红、紫及蓝4个色系的植株(胡可等, 2009)。采摘4个色系植株盛花期的新鲜舌状花用于色素提取。将4个色系植株的叶片液分别于氮速冻后保存在-20℃冰箱用于基因组DNA提取。将蓝色系瓜叶菊不同发育级别的舌状花和1级管状花以及白色系瓜叶菊的1级舌状花取下后分别于液氮中速冻后保存在-80℃冰箱用于RNA提取(胡可等, 2009)。
3.2瓜叶菊舌状花中类黄酮的紫外-可见吸收光谱分析
取新鲜舌状花1 g,加提取剂甲醇:甲酸:水=98:1:1 (v/v/v) 10 mL,于4℃冰箱,避光条件下过夜浸提。观察到舌状花几乎呈无色。提取液于5 000 rpm离心5 min,取上清液备用。使用TU-1901双光束紫外-可见光分光光度计(北京普析通用仪器有限责任公司)测定提取液在280~600 nm波长范围内的吸收光谱(采样间隔0.5 nm, 快速扫描, 石英比色皿光径为1 cm)。
3.3 Southern blot分析
用CTAB法提取瓜叶菊基因组DNA,用分光光度计(SmartSpec Plus Spectrophotometer, Bio-Rad Laboratories, Inc.)测量DNA纯度及浓度,分别用EcoRⅠ和BamHⅠ酶切基因组DNA(30 µg),将酶切产物在0.8%琼脂糖上进行电泳。转印至硝酸纤维素膜(Hybond N+ membrane, Amersham)。根据已知序列编码区的保守区设计探针,长度约500 bp,上游引物为F3H1:3'-GGNGGNAARAARGGNGGNTTYAT-5',下游引物为F3H2:3'-CANCANGCYTGRTGRTCNGCRTT-5',PCR扩增采用的模板为克隆至pGM-T Easy载体中的瓜叶菊F3H同源基因片段,并用DIG (digoxigenin, Roche)进行标记。杂交及信号检测操作均按照DIG杂交试剂盒(DIG hybridization Kit, Roche)说明书进行。
3.4 Northern blot分析
采用改良CTAB法提取瓜叶菊中不同材料的总RNA (孟丽等, 2006),用DNase (Promega Corporation)消化基因组DNA,用分光光度计(SmartSpec Plus Spectrophotometer, Bio-Rad Laboratories, Inc.)测量RNA的浓度,并且用rRNA条带的EB染色亮度进行定量,确定每个泳道的上样量一致。每个泳道中总RNA的上样量为20 µg,采用Sambrook和Russell (2001)的方法进行RNA电泳及转印至硝酸纤维素膜(Hybond N+ membrane, Amersham)操作(Sambrook and Russell, 2001)。探针制备同3.3。杂交及信号检测操作均按照杂交试剂盒(DIG hybridization Kit, Roche)说明书进行。
作者贡献
孙翊是本研究的实验设计和实验研究的执行人;孙翊完成数据分析,论文初稿的写作;孟丽和胡可参与实验设计,试验结果分析以及论文修改;戴思兰是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都已经阅读本文并同意最终的文本。
致谢
本项研究工作得到国家自然科学基金(No.30671714和No.31071823),国家林业局林业公益性行业科研专项(No.200904050)、中国科学院方向性项目(No.KSCX2-YW-N-043)以及高等学校博士学科点专项科研基金(20070022009)项目共同资助。
参考文献
Bai X.X., and Dai S.L., 2005, Application of antisense RNA technology in production of color-altered flowers, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 22(3): 284-291 (白新祥, 戴思兰, 2005, 反义RNA技术在花色育种中的应用, 植物学通报, 22(3): 284-291)
Britsch L., and Grisebach H., 1986, Purification and characterization of (2S)-flavanone 3-hydroxylase from Petunia hybrida, European Journal of Biochemistry, 156(3): 569-577 doi:10.1111/j.1432-1033.1986.tb09616.x
Britsch L., Ruhnau-Brich B., and Forkmann G., 1992, Molecular cloning, sequence analysis, and in vitro expression of flavanone 3 beta-hydroxylase from Petunia hybrida, Journal of Biological Chemistry, 267(8): 5380-5387
Charrier B., Coronado C., Kondorosi A., and Ratet P., 1995, Molecular characterization and expression of alfalfa (Medicago sativa L.) flavanone 3-hydroxylase and dihydroflavonol-4-reductase encoding genes, Plant Molecular Biology, 29(4): 773-786 doi:10.1007/BF00041167
Clegg M.T., and Durbin M.L., 2000, Flower color variation: A model for the experimental study of evolution, Proceedings of the National Academy of Sciences of the United States of America, 97(13): 7016-7023 doi:10.1073/pnas.97.13.7016
Davies K.M., 1993, A cDNA clone for flavanone 3-hydroxylase from Malus, Plant Physiology, 103(1): 291 doi:10.1104/pp.103.1.291
Deboo G.B., Albertsen M.C., and Taylor L.P., 1995, Flavanone 3-hydroxylase transcripts and flavonol accumulation are temporally coordinate in maize anthers, The Plant Journal, 7(5): 703-713 doi:10.1046/j.1365-313X.1995.07050703.x
Gong Z., Yamazaki M., Sugiyama M., Tanaka Y., and Saito K., 1997, Cloning and molecular analysis of structural genes involved in anthocyanin biosynthesis and expressed in a forma-specific manner in Perilla frutescens, Plant Molecular Biology, 35(6): 915-927 doi:10.1023/A:1005959203396
Han K.T., Hu K., and Dai S.L., 2008, Flower color breeding by molecular design in ornamentals, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 6(1): 16-24 (韩科厅, 胡可, 戴思兰, 2008, 观赏植物花色的分子设计, 分子植物育种, 6(1): 16-24)
Himi E., Nisar A., and Noda K., 2005, Colour genes (R and Rc) for grain and coleoptile upregulate flavonoid biosynthesis genes in wheat, Genome, 48(4): 747-754 doi:10.1139/g05-026
Hodges S.A., and Derieg N.J., 2009, Adaptive radiations: From field to genomic studies, Proceedings of the National Academy of Sciences of the United States of America, 106(1): 9947-9954 doi:10.1073/pnas.0901594106
Hou F.Y., Wang Q.M., Li A.X., Zhang H.Y., Dong S.X., and Xie B.T., 2009, Study progress on anthocyanidin synthase of plants, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 25(21): 188-190 (侯夫云, 王庆美, 李爱贤, 张海燕, 董顺旭, 解备涛, 2009, 植物花青素合成酶的研究进展, 中国农学通报, 25(21): 188-190)
Hu K., Meng L., Han K.T., Sun Y. and Dai S.L., 2009, Isolation and expression analysis of key genes involved in anthocyanin biosynthesis of cineraria, Yuanyi Xuebao (Acta Horticulturae Sinica), 36(7): 1013-1022 (胡可, 孟丽, 韩科厅, 孙翊, 戴思兰, 2009, 瓜叶菊花青素合成关键结构基因的分离及表达分析, 园艺学报, 36(7): 1013-1022)
Koes R.E., Spelt C.E., Van den Elzen P.J.M., and Mol J.N.M., 1989, Cloning and molecular characterization of the chalcone synthase multigene family of Petunia hybrida, Gene, 81(2): 245-257 doi:10.1016/0378-1119(89)90185-6
Li J., and Che D.D., 2004, Progress in gene modified breeding of ornamental plants, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 2(1): 101-104 (李静, 车代弟, 2004, 花卉基因工程育种研究进展, 分子植物育种, 2(1): 101-104)
Martin C., Prescott A., Mackay S., Bartlett J., and Vrijlandt E., 1991, Control of anthocyanin biosynthesis in flowers of Antirrhinum majus, The Plant Journal, 1(1): 37-49 doi:10.1111/j.1365-313X.1991.00037.x doi:10.1046/j.1365-313X.1991.t01-14-00999.x
Meng L., and Dai S.L., 2004, F3'5'H genes regulation and blue flowers formation, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 2(3): 413-420 (孟丽, 戴思兰, 2004, F3'5'H基因与蓝色花的形成, 分子植物育种, 2(3): 413-420)
Meng L., Zhou L., Zhang M. S., and Dai S.L., 2006, An efficient and economic method for preparation total RNA of petals, Shengwu Jishu (Biothechnology), 16(1): 38-40 (孟丽, 周琳, 张明姝, 戴思兰, 2006, 一种有效的花瓣总RNA的提取方法, 生物技术, 16(1): 38-40)
Pelletier M.K. and Shirley B.W., 1996, Analysis of flavanone 3-hydroxylase in Arabidopsis seedlings (Coordinate regulation with chalcone synthase and chalcone isomerase), Plant Physiol, 111(1): 339-345 doi:10.1104/pp.111.1.339
Pelt J.L., Downes W.A., Schoborg R.V., and McIntosh C.A., 2003, Flavanone 3-hydroxylase expression in Citrus paradisi and Petunia hybrida seedlings, Phytochemistry, 64(2): 435-444 doi:10.1016/S0031-9422(03)00341-8
Sambrook J., and Russell D.W., eds., 2001, Molecular Cloning: A Laboratory Manual (3rd ed), Cold Spring Harbor Laborary Press, New York, pp31-41
Schijlen E.G.W., de Vos C.H.R., Van Tunen A.J., and Bovy A.G., 2004, Modification of flavonoid biosynthesis in crop plants, Phytochemistry, 65(19): 2631-2648 doi:10.1016/j.phytochem.2004.07.028
Shen G.A., Pang Y.Z., Wu W.S., Deng Z.X., Zhao L.X., Cao Y.F., Sun X.F., and Tang K.X., 2006, Cloning and characterization of a flavanone 3-hydroxylase gene from Ginkgo biloba, Bioscience Reports, 26(1): 19-29 doi:10.1007/s10540-006-9007-y
Shen X.Y., Martens S., Chen M.L., Li D.F., Dong J.L., and Wang T., 2010, Cloning and characterization of a functional flavanone-3 beta-hydroxylase gene from Medicago truncatula, Molecular Biology Reports, 37(7): 3283-3289 doi:10.1007/s11033-009-9913-8
Sparvoli F., Martin C., Scienza A., Gavazzi G., and Tonelli C., 1994, Cloning and molecular analysis of structural genes involved in flavonoid and stilbene biosynthesis in grape (Vitis vinifera L.), Plant Molecular Biology, 24(5): 743-755 doi:10.1007/BF00029856
Sun W., Li C.H., Wang L.S., and Dai S.L., 2010, Accumulation and variation of anthocyanins in blue flowers of Senecio cruentus at different flowering stages, Beijing Linye Daxue Xuebao (Journal of Beijing Forestry University), 32(3): 128-134 (孙卫, 李崇晖, 王亮生, 戴思兰, 2010, 蓝色瓜叶菊花青苷在花发育过程中的积累和变化规律, 北京林业大学学报, 32(3): 128-134)
Sun W., Li C.H., Wang L.S., Dai S.L., and Xu Y.J., 2009, Anthocyanins present in flowers of Senecio cruentus with different colors, Yuanyi Xuebao (Acta Horticulturae Sinica), 36(12): 1775-1782 (孙卫, 李崇晖, 王亮生, 戴思兰, 徐彦军, 2009, 花青苷成分对瓜叶菊花色的影响, 园艺学报, 36(12): 1775-1782)
Tanaka Y., Sasaki N., and Ohmiya A., 2008, Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids, Plant Journal, 54(4): 733-749 doi:10.1111/j.1365-313X.2008.03447.x
Tanaka, Y., Tsuda S., and Kusumi T., 1998, Metabolic engineering to modify flower color, Plant and cell physiology, 39(11): 1119-1126
Tanaka Y., and Ohmiya A., 2008, Seeing is believing: engineering anthocyanin and carotenoid biosynthetic pathways, Current Opinion in Biotechnology, 19(2): 190-197 doi:10.1016/j.copbio.2008.02.015
Tateishi, N., Ozaki Y., and Okubo H., 2010, Molecular cloning of the genes involved in Anthocyanin biosynthesis in Camellia japonica, Journal of the Faculty of Agriculture Kyushu University, 55(1): 21-28
Wu S.H., and Zhang D.S., 2002, Cloning of full length fragment of f3h gene of anthocyanin biosynthesis from fruit peel of Red Bartllet pear, Fujian Nonglin Daxue Xuebao (Journal of Fujian Agriculture and Forestry University (Natural Science Edition)), 31(3): 361-365 (吴少华, 张大生, 2002, 红巴梨果实花青素生成相关基因f3h全长片段的克隆, 福建农林大学学报(自然科学版), 31(3): 361-365)
Xu Q.Y., and Dai S.L., 2004, Blue flowers' molecular breeding, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 2(1): 93-99 (徐清燏, 戴思兰, 2004, 蓝色花卉分子育种, 分子植物育种, 2(1): 93-99)
Zuker A., Tzfira T., Ben-Meir H., Ovadis M., Shklarman E., Itzhaki H., Forkmann G., Martens S., Neta-Sharir I., Weiss D., and Vainstein A., 2002, Modification of flower color and fragrance by antisense suppression of the flavanone 3-hydroxylase gene, Molecular Breeding 9(1): 33-41 doi:10.1023/A:1019204531262